A New Approach to Gut–heart axis
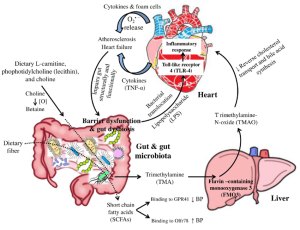
The human intestinal flora is closely related to human health. Gut microbiota dysbiosis is involved in the occurrence and development of various diseases, including coronary heart disease, hypertension, diabetes, inflammatory bowel diseases, and a wide range of inflammatory, metabolic, and neurological disorders. Studies in the last decade have proved that gut microbiota dysbiosis plays a crucial part in host inflammation and the formation of atherosclerosis and hypertension.
Challenges and future perspectives
It is difficult to apply what is known about microbiome composition and function in therapeutic settings. The dynamic nature of the microbiome, particularly it changes throughout illness development and in response to numerous variables such as nutrition, lifestyle, and pharmaceutical therapies, must be understood in order to address this, which calls for longitudinal investigations. Deeper research projects employing cutting-edge approaches like next-generation sequencing, metatranscriptomics, metaproteomics, and metabolomics, as well as computational methodologies, are currently of the utmost importance.۴ We can now investigate the complex interactions of the Heart–Gut axis thanks to these instruments. We will be able to identify the processes by which the gut microbiota affects medication metabolism and response by merging functional analysis, simultaneous profiling of the gut microbiome, metabolomics, and other omics data. These multifaceted techniques have a great deal of promise for unravelling the complex mechanisms by which the gut microbiota interacts with the host, ultimately revealing insightful information for enhancing medication, therapy and enhancing patient outcomes.
Targeting gut microbiota as a therapeutic option
- There is interest in employing microbiome-based therapeutics as a possible therapeutic option for CVDs given the potential impact of the gut microbiota on cardiovascular health. Probiotics, which are living bacteria that provide health advantages when taken in sufficient quantities, are one strategy. Numerous beneficial bacterial strains like bifidum, L. casei, L. Acidophilus, L. zisttakhmir, L. reuteri, L.fermentum, C. butyricum, B.breve,have been tested for the treatment of CVDs both in animal models and humans.
- Prebiotics and CVDs study is still in its infancy, but there is mounting evidence that they may have beneficial effects on several risk factors for cardiovascular disease like-blood pressure, cholesterol management, chronic inflammation, oxidative stress, glucose metabolism, and weight management. However, further studies are required to evaluate the effectiveness of these probiotics and the best dosage.
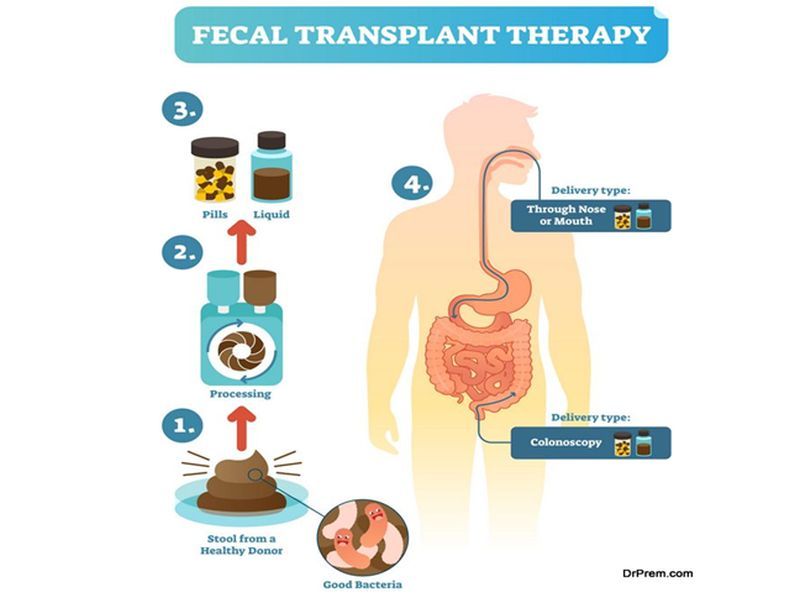
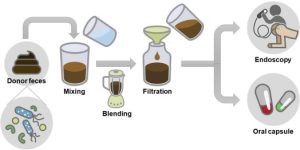
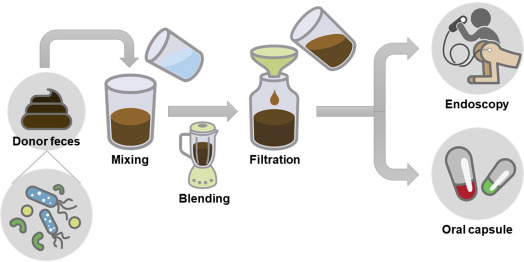
- Another method is fecal microbiota transplantation (FMT), which involves inserting healthy donor’s feces into the recipient’s gut. Although research is still being done to determine FMT’s potential therapeutic function in CVDs, it has historically been utilized largely to treat illnesses like Clostridium difficile Following FMT, preliminary research in animal models has demonstrated encouraging improvements in cardiovascular parameters and atherosclerotic reduction. The use of gut microbiota-based therapeutics for CVDs is still in its infancy, and more study is required to completely comprehend the intricate relationships between the gut and the heart and to assess the efficacy and safety of these strategies. Individual differences in gut microbial makeup and responsiveness to therapies may also provide challenges in developing personalized therapy modules and regimen.
- Research has shown AST-120, an oral charcoal adsorbent to have beneficial effect in the treatment of CVDs. However, it is unclear how adsorbents may affect the gut microbiota’s composition and its associated metabolites in people with CVDs.
Reference
Majumder S, Kirtikumar RM, Shetty V, Mukherjee S, Narayan P. Cardiovascular diseases and the heart–gut cross talk. Indian Heart Journal. 2023 Dec 7.
Provided by: Dr. Nazila Kassaian