افراد بسیاری، در طول زندگی خود، ناراحتی های گوارشی را تجربه می کنند، اما سندروم روده تحریک پذیر (IBS)، اندکی متفاوت است. ازعلائم این بیماری، دل درد، اسهال و یا یبوست می باشد که به طور مکرر رخ می دهد. با این وجود، هیچ نشانی از آسیب به سیستم گوارشی وجود ندارد. بیماران احساس می کنند عمل دفعشان به طور کامل صورت نپذیرفته است. بسیاری از مبتلایان دچار نفخ شده و علاوه بر مشاهده تورم شکم، صداهایی را از شکم خود می شنوند. داشتن درد مزمن و اجابت مزاج های پی در پی، از دیگر مسائل آزاردهنده مبتلایان به این سندروم است.
فوق تخصص گوارش و کبد از مرکز تحقیقات گوارش و کبد دانشگاه علوم پزشکی اصفهان گفت بررسی ها نشان می دهد شیوع IBS در زنان دو برابر مردان است و حدود ۴۰ درصد بیماران به IBS خفیف، ۳۵ درصد به IBS متوسط و ۲۵ درصد به IBS شدید مبتلا هستند. علائم روده تحریک پذیر، اغلب پیش از ۳۵ سالگی بروز پیدا می کند. بسیار نامتعارف است که افراد بالای ۵۰ سال، برای اولین بار، دچار این عارضه بشوند.
بابک تمیزی فر گفت: عوامل مختلفی می توانند در ایجاد سندرم روده تحریک پذیر نقش داشته باشند که برخی از آنها بیشتر از سایرین شایع هستند و می توان با مصرف کپسول colperIBS شرکت زیست تخمیر علائم را کاهش داد.
دلائل عمده سندروم روده تحریک پذیر (IBS)
- رشد بیش از حد باکتری های روده کوچک: چنانچه باکتری هایی که معمولا در روده بزرگ یافت می شوند بتوانند در روده کوچک رشد کنند افراد از علائمی مانند درد و کرامپ شکمی مداوم ، نفخ و اسهال گلایه دارند. همچنین رشد بیش از حد میکروارگانیسم های مولد گاز در روده کوچک یا روده بزرگ منجر به یبوست در آن ها می شود.
- افزودنی های مواد غذایی: مصرف مواد غذایی فرآوری شده در دهه های اخیر در اکثر کشورها به شدت روند رو به رشدی داشته است. تغییر در محیط میکروبی روده به دلیل استفاده از افزودنی های غذایی می تواند یکی از علل IBS در جوامع باشد. شیرین کننده های مصنوعی نیز می توانند علائم IBS را تشدید کنند. ایجاد IBS با تغییر در میکروبیوم دستگاه گوارش مرتبط است و بنابراین غذاهایی که هضم ضعیفی دارند موجب اختلالات گوارشی بیشتری می شوند.
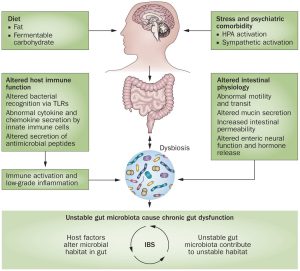
- استرس: در افراد مبتلا به IBS، استرس می تواند آغازگر علائم و یا باعث پیشرفت علائم باشد، بنابراین بسیار مهم است که این افراد همیشه بر استرس خود کنترل داشته باشند. شاید صحبت کردن با یک مشاور، به منظور آموختن راه هایی جهت کنترل استرس، راه حل خوبی برای ایشان باشد.
او ادامه داد، عصاره نعنا فلفلی موجود در کپسول colperIBS شرکت زیست تخمیر با اثر مستقیم روی عضلات روده باعث ریلکس شدن این عضلات میشود. اما به دلیل اثر بر روی عضله ابتدایی معده باعث رفلاکس میشود. استفاده از کپسول انتریک کوت راه حل مناسبی برای جلوگیری از ایجاد اثر بر معده است؛ چرا که با این روش، میتوان از اثرگذاری آن در روده بهرهمند شد و برای رفع دردهای شکمی و تسکین مشکلات شکمی، این ترکیب را به عضلات رودهی افراد مبتلا به سندروم روده تحریک پذیر رساند.