بی اشتهایی عصبی یک اختلال رایج خوردن در زنان نوجوان است که درمان موفقیت آمیزی ندارد. مطالعات انسانی و حیوانی اخیر، پیوندهای جدیدی را بین تغییر میکروبیوتای روده، اشتها و تنظیم وزن بدن در بیاشتهایی عصبی نشان داده است.
بی اشتهایی عصبی یک اختلال روانپزشکی بوده که با سوءتغذیه شدید مزمن و گرسنگی مشخص می شود. در اکثر موارد این بیماری در آغاز نوجوانی شروع و کم کم به یک بیماری پایدار تبدیل می شود که در ۴۰ درصد موارد می تواند کشنده باشد. اگرچه درمان بی اشتهایی ترکیبی از گفتار درمانی با تغذیه مجدد است، نتایج نشان داده است که این روش اثربخشی محدودی در بازگرداندن تعادل جسمی و روانی دارد. مطالعات محدودی پیرامون اهمیت ارتباط روده و مغز و تغییرات میکروبیوم روده در ایجاد بی اشتهایی وجود دارد. با این حال، تعیین نقش دقیق میکروبیوتای روده در بی اشتهایی کلیدی برای مداخلات بالینی است.
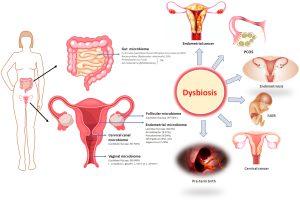
نقش میکروارگانیسم ها در بی اشتهایی عصبی
دانشمندان دریافتند که در مقایسه با زنان سالم با وزن مناسب، تفاوت هایی در سطوح هر دو جمعیت ویروسی و باکتریایی نمونه مدفوع زنان مبتلا به بی اشتهایی وجود دارد و با افزایش غلظت و تنوع ویروسی، تنوع کلی باکتری کاهش می یابد. با تجزیه و تحلیل ترکیب باکتری های روده هر فرد، متوجه شدند که در زنان مبتلا به بی اشتهایی، سطوح برخی باکتری های مشخص بالا و سطح برخی کاهش داشته و عملکرد آنها نیز تغییر کرده است. به عنوان مثال، کاهش باکتری تولید کننده ویتامین B1 ممکن است کاهش این ویتامین را در بیماران بی اشتهایی عصبی توضیح دهد.
۳۵ متابولیت سرمی مربوط به میکروبیوتا در آزمایش خون این بیماران نیز یافته شده است که با بی اشتهایی در ارتباط هستند، مانند افزایش سطح اسیدهای صفراوی ثانویه و متابولیت های تریپتوفان که در تنظیم سیری و فعالیت سروتونین نقش دارند. این عناصر ممکن است منشأ عدم حساسیت به گرسنگی بوده و در نتیجه به حفظ بی اشتهایی عصبی کمک کنند. با توجه به این موضوع، علائم اختلال خوردن از طریق پرسشنامه ای توسط بیماران تکمیل شد که نشان داد بین فراوانی باکتری های خاص و اعتماد به نفس پایین، کمالگرایی و عدم تعادل عاطفی ارتباط وجود دارد. علائم خاص مرتبط با بی اشتهایی عصبی، مانند تمایل شدید لاغری و نارضایتی از بدن نیز با میکروبیوم روده ارتباط دارند.
دانشمندان همچنین تأثیر میکروبیوتا بر علائم بی اشتهایی را از طریق پیوند نمونههای مدفوع (FMT) از شرکتکنندگان مبتلا به بیاشتهایی و شرکت کنندگان با وزن سالم به موشهای فاقد میکروبهای رودهای مقلد بی اشتهایی با رژیم غذایی محدود سنجیدند. نتایج نشان داد که موشهای دریافت کننده میکروبیوم افراد بیاشتها در ابتدا وزن بیشتری از دست داده و در طول زمان کاهش وزن کمتری داشتند. نتایج این مطالعه همچنین نشان داد که در موشهایی که میکروبیوم افراد بیاشتها را دریافت کردند، بیان برخی از ژنهای سرکوبکننده اشتها (برای مثال، ژنهای Bdnf و Cartpt) در مرکز کنترل اشتهای مغز (هیپوتالاموس) افزایش یافت. در سطح بافت چربی نیز ژنهایی که چربی سفید (ذخیره انرژی) را به چربی قهوهای (مبدل انرژی به گرمای بدن) تبدیل میکنند افزایش یافتند. این نتایج نقش بالقوه تغییرات میکروبیوم روده را در بهبود بی اشتهایی برجسته می کند. با این حال، این روابط علت و معلولی مستلزم بررسی های دقیق هستند.
نتیجه گیری
اگرچه ترکیبی از درمانهای تغذیهای و روانپزشکی باید در هسته اصلی درمان بی اشتهایی باشد اما تجزیه و تحلیل بیشتر لازم است تا با روش هایی از قبیل از بین بردن میکروب های تغییریافته با آنتی بیوتیک ها یا استفاده از FMT یا پروبیوتیک برای القای میکروب های مفید، نقش میکروبیوم روده در بهبودی بی اشتهایی را بسنجد. با اینکه بازگشت وزن نقش اصلی را در توانبخشی تغذیه ای در افراد مبتلا به بی اشتهایی عصبی دارد، با توجه به یافته های فعلی، میکروبیوم روده نیز باید به عنوان بخشی از مداخلات بالینی تغذیه برای درمان بهینه بی اشتهایی در نظر گرفته شود.
مترجم: فاطمه زری میدانی (Fatemeh Zari Meidani)
ویراستار: مرضیه رحیم خراسانی (Marzieh Rahim khorasani)
رفرنس ها:
- Fan Y, Støving RK, Berreira Ibraim S, et al. The gut microbiota contributes to the pathogenesis of anorexia nervosa in humans and mice. Nat Microbiol. ۲۰۲۳;۸(۵):۷۸۷-۸۰۲. doi:۱۰.۱۰۳۸/s41564-023-01355-5
- Hildebrandt T, Peyser D. The gut microbiome in anorexia nervosa. Nat Microbiol. ۲۰۲۳;۸(۵):۷۶۰-۷۶۱. doi:۱۰.۱۰۳۸/s41564-023-01372-4