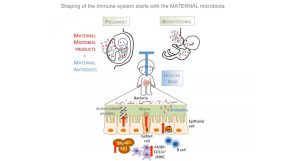
تا چندی پیش تصور می شد رشد میکروبیوتای روده شیرخواران تا ۳ سالگی کامل می شود. مطالعات جدید نشان می دهند که میکروارگانیسم های روده تا سن ۲۰ سالگی به تکامل خود ادامه می دهند. در واقع، تشکیل میکروبیوتای روده از هنگام تولد شروع می شود، در طول بزرگسالی نسبتا پایدار بوده و در سنین بالاتر، با کاهش پایداری و عملکرد روبرو می شود. با این وجود چگونگی تکامل میکروبیوتای روده هنوز در هاله ای از ابهام است.
میکروبیوتای روده پس از ۳ سالگی هم به تکامل خود ادامه می دهند؟
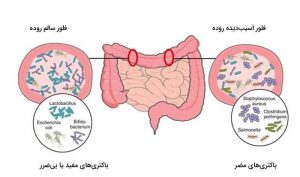
تغییرات در ترکیب میکروبیوتای روده در کودکان سنین قبل مدرسه (۳-۶ سالگی) و سنین مدرسه (۷-۱۲ سالگی) دیده شده است. شاخصه های میکروبیوتای روده در این گروه های سنی شامل افزایش گونه های مفید بیفیدوباکتریوم و باکتری های تولیدکننده بوتیرات (مانند گونه های رومینوکوکوس و فکالیباکتریوم) و کاهش آرکی باکتری های تولید کننده ی گاز متان میباشد.
تغییر عمده دیگر در ترکیب میکروبیوم روده، در ۲۰ سالگی گزارش شده است. در مطالعه بزرگی در چین، ۱۰۰۰ فرد سالم با سن بین ۳ تا بیش از ۱۰۰ سال، تحت بررسی میکروبیوتای روده قرار گرفتند. دانشمندان متوجه شدند که تفاوت اصلی میکروبیوم روده بین گروه های سنی مختلف، در گروه ۱۰ تا ۲۴ سال دیده می شود. نکته قابل توجه در این مطالعه این بود که کودکان زیر ۱۰ سال نسبت به بالغین میکروبیوتای قارچی غنی تری داشتند که ارتباط آن با پیامد های سلامت در حال حاضر ناشناخته است. پیشنهاد می شود برای اطمینان از مدت لازم برای رشد میکروبیوتای روده، مطالعات مشابه در سایر کشورها تکرار شود. ولی به نظر می رسد تکامل میکروبیوتا بیشتر از انچه قبلا تصور می شد، طول بکشد.
از تفاوت در ترکیب میکروبیوتا بین کودکان و بزرگسالان، چه برداشتی می توان کرد؟
اکنون که اطلاعات بیشتری درباره ی تغییرات در ترکیب میکروبیوتای روده در سنین مختلف داریم، لازم است بدانیم تغییرات میکروب های روده در سلامت بدن چه اثری دارند و از این یافته ها چه استفاده ای می کنیم؟
تکامل میکروبیوتای روده نشان دهنده ی حرکت به سمت تنوع باکتریایی و فرایندهای مهمی مانند تجزیه کربوهیدرات های پیچیده، تشکیل اسیدهای چرب زنجیره کوتاه، متابولیسم داروها و آلاینده های محیطی می باشد. محققین دریافتند هرچه رژیم افراد بر پایه ی گیاهان بیشتر باشد، پاسخ متابولیکی به گلوکز بهتر است. در مجموع عملکرد های میکروبیوم روده به رشد و نمو کودکان کمک و تنوع میکروبیوتا و سلامتی در بالغین را منعکس می کند.
به طور خلاصه، مطالعات جدید نشان داده اند که میکروبیوم روده، آهسته تر از آنچه قبلا تصور می شد، تکامل می یابد. ازآنجایی که رژیم غذایی یکی از مهم ترین عوامل تاثیرگذار بر تکوین میکروبیوم روده است،یافته ها نشان می دهند جهت بهبود رژیم کودکان و بالغین جوان، ارتقا طولانی مدت سلامت و پیشگیری از بیماری ها هنوز به زمان بیشتری احتیاج هست. به عبارت دیگر، از آنجاییکه بیشترین اصلاح ساختاری در ترکیب میکروبیوتای روده تا سن ۲۰ سالگی اتفاق می افتد، فرصت طلایی داشتن تغذیه و سبک زندگی مطلوب را که ضامن سلامتی است در کودکان و نوجوانان خود از دست ندهید.
مترجم: سیده زینب حسینیان(Zeynab Hoseynian)
ویراستار: نازیلا کسائیان(Nazila Kassaian)، مرضیه رحیم خراسانی( Marzieh Rahim khorasani)
References
Selma-Royo M, Tarrazó M, García-Mantrana I, et al. Shaping microbiota during the first 1000 days of life. Adv Exp Med Biol. 2019; 1125:3-24. doi: ۱۰.۱۰۰۷/۵۵۸۴_۲۰۱۸_۳۱۲.
Hollister EB, Riehle K, Luna RA, et al. Structure and function of the healthy pre-adolescent pediatric gut microbiome. Microbiome. 2015; 3:36. doi: ۱۰.۱۱۸۶/s40168-015-0101-x.
Bian G, Gloor GB, Gong A, et al. The gut microbiota of healthy aged Chinese is similar to that of the healthy young. mSphere. 2017; 2(5):e00327-17. doi: ۱۰.۱۱۲۸/mSphere.00327-17.
Zhong H, Penders J, Shi Z, et al. Impact of early events and lifestyle on the gut microbiota and metabolic phenotypes in young school-age children. Microbiome. 2019; 7(1):2. doi: ۱۰.۱۱۸۶/s40168-018-0608-z.
Derrien M, Alvarez AS, de Vos WM. The gut microbiota in the first decade of life. Trends Microbiol. 2019; 27(12):997-1010. doi: ۱۰.۱۰۱۶/j.tim.2019.08.001.