در حالی که محبوب ترین میکروبیوتایی که ممکن است در مورد آن شنیده باشید میکروبیوتای روده است، واژن نیز میکروبیوتا دارد. در مورد رابطه بین این دو و اینکه چرا مراقبت از میکروبیوتای روده برای میکروبیوتای واژن اهمیت دارد بیشتر بدانید.
چرا میکروبیوتای واژن برای سلامتی مهم است؟
میکروارگانیسم ها در هر ناحیه ای از بدن که در معرض خارج قرار دارد وجود دارند: پوست، گوش، بینی، مجاری تنفسی و واژن. میکروبیوتای واژن از تعداد زیادی باکتری (عمدتاً گونه های لاکتوباسیلوس) و تعداد کمی قارچ (بیشتر کاندیدا آلبیکنس) تشکیل شده است. نکته مهم این است که برخلاف میکروبیوتای روده، میکروبیوتای واژن در شرایطی که تنوع آن کم باشد، وضعیت خوبی دارد. هنگامی که سایر باکتری ها (گاردنرلا واژینالیس، آتوپوبیوم واژن و دیگران) یا قارچ ها (گونه های کاندیدا) بیش از حد رشد می کنند و لاکتوباسیل ها کاهش می یابند، عفونت واژن می تواند ظاهر شود.
نقش میکروبیوتای واژن
- تولید ترکیبات دفاعی، مانند اسید لاکتیک و مواد ضد میکروبی
- عمل به عنوان یک مانع و تحریک تولید موکوس توسط اپیتلیوم واژن
- حمایت از سیستم ایمنی بدن زنان
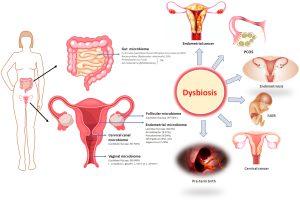
راهیابی میکروب های مضر از روده به واژن
انتقال باکتری از رکتوم به واژن یکی از چندین علت شناخته شده عفونت های واژن است. اگرچه روده انسان محلی برای میکروارگانیسم هایی است که به عنوان میکروبیوتای سالم روده شناخته می شوند، اما زمانی که به واژن سفر می کنند ممکن است مشکلاتی ایجاد کند. این موضوع در مورد برخی از باکتری ها مانند اشریشیا کلی و برخی قارچ ها مانند گونه های کاندیدا صدق می کند. هنگامی که این میکروارگانیسمها از رکتوم به واژن حرکت کرده و در آن رشد میکنند سبب عدم تعادل میکروبیوتای واژن شده و منجر به عفونت آن می شود.
تجویز و استفاده از پروبیوتیک ها منجر به مهاجرت میکروب های مفید از روده به واژن می شود و این امر بر سلامت واژن اثرگذار است. بنابراین اگر میکروبیوتای روده شما در وضعیت خوبی قرار داشته باشند، میکروبیوتای واژن شما نیز در حالت محافظتی قرار خواهند گرفت. میکروبیوتای روده نیز می توانند هورمون های استروژن را متابولیزه و به جای دفع از طریق مدفوع، منجر به تجمع آنها در بدن شود بنابراین افزایش استروژن در واژن باعث افزایش تولید گلیکوژن به عنوان منبع غذایی برای لاکتوباسیل های مفید می شود.
عدم تعادل میکروبیوم واژن منجر به واژینوز باکتریایی می شود
بسته به چرخه قاعدگی، رژیم غذایی، اقدامات بهداشتی، داروها، استرس و بیماری میکروبیوتای واژن هر زن متفاوت است. رشد بیش از حد میکروارگانیسمهای بیماریزا در واژن میتواند در نیمی از زنان بدون علامت و یا همراه با ترشحات غلیظ و سفید با بوی ماهی گندیده، درد یا خارش همراه باشد.
تغییر میکروبیوتای واژن یا دیس بیوز واژن با واژینوز باکتریایی، برفک، عفونت های مکرر دستگاه ادراری و حتی کاهش باروری همراه است. این یافتهها امکان اصلاح میکروبیوتای واژن را بهطور مستقیم یا غیرمستقیم با تأثیر بر میکروبیوتای روده برای بهبود سلامت زنان باز میکند.
نتیجه گیری
پاتوژن های روده می توانند به داخل واژن رفته و به بر هم خوردن تعادل میکروبی واژن کمک کنند؛ بنابراین مراقبت از روده قطعا سلامت واژن را بهبود می بخشد.
مترجم: راحم رحمتی (Rahem Rahmati)، پریسا هاشمی ( Parisa Hashemi)
ویراستار: مرضیه رحیم خراسانی (Marzieh Rahim khorasani)
References