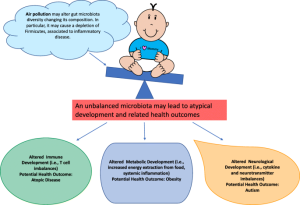
مطالعات اخیر نشان می دهد ارتباط عمیقی بین میکروبیوتای روده و بیماری های مختلف، به ویژه سرطان، وجود دارد. میکروبیوتای روده که تعداد بی شماری از باکتری ها، ویروس ها، قارچ ها و سایر میکروارگانیسم ها را در بر می گیرد، از طریق مکانیسم های مختلف نقشی اساسی در حفظ سلامت میزبان ایفا می کند. میکروبیوتای روده به عنوان یک تنظیم کننده حیاتی عمل می کند و بر پاسخ ایمنی تأثیرگذار است در نتیجه بر توانایی بدن برای شناسایی و از بین بردن سلول های سرطانی موثر می باشد. تحقیقات نشان می دهد که تغییرات در ترکیب محیط میکروبی روده میتواند باعث ایجاد اختلال در سیستم ایمنی شود و به طور بالقوه در شروع و پیشرفت تومور نقش داشته باشد.
تغییر میکروبیوم روده و سرطان
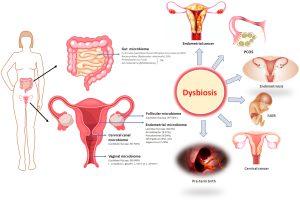
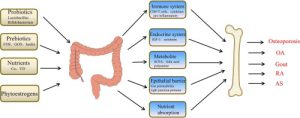
میکروبیوتای روده به طور فعال در تولید متابولیت و تعدیل در محیط روده شرکت می کند. برخی از باکتری ها متابولیت هایی مانند اسیدهای چرب با زنجیره کوتاه (SCFAs) تولید می کنند که خواص ضد التهابی دارند و به حفظ یکپارچگی سد روده کمک می کنند. برعکس، دیس بیوز، عدم تعادل در ترکیب میکروبی روده، میتواند منجر به تولید متابولیتهای مضر، تحریک التهاب و آسیب سلولی شود و در نتیجه محیطی مناسب برای سرطانزایی ایجاد کند. به عنوان مثال، در سرطان کولورکتال ارتباط قوی با دیس بیوز میکروبی روده نشان داده می شود. مطالعات تغییراتی را در ترکیب میکروبیوتای روده در افراد مبتلا به سرطان کولورکتال شناسایی کردهاند که بر نقش بالقوه گونههای باکتریایی خاص در ترویج یا مهار رشد تومور تاکید میکند.
تاثیر میکروبیوم روده بر سرطان
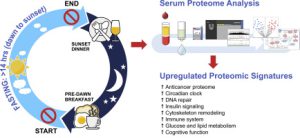
تحقیقات در حال ظهور تأثیر میکروبیوتای روده را بر اثربخشی درمانهای سرطان روشن کرده است. روش درمانی ایمونوتراپی که سیستم ایمنی را برای مبارزه با سرطان مهار می کند، با میکروبیوتای روده مرتبط است. مطالعات نشان دادهاند که جمعیتهای میکروبی خاص در روده میتوانند بر پاسخ به ایمونوتراپی تأثیر گذار باشند و پتانسیل دستکاری میکروبیوتای روده برای افزایش نتایج درمان را دارند.
اکتشاف نقش میکروبیوتای روده در سرطان، علاقه قابل توجهی را به مداخلات درمانی با هدف قرار دادن میکروبیوم برانگیخته است. رویکردهایی مانند پروبیوتیک ها، پری بیوتیک ها، اصلاح رژیم غذایی، و پیوند میکروبیوتای مدفوع (FMT) به عنوان استراتژی های بالقوه برای تعدیل میکروبیوتای روده و در نتیجه، تأثیر بر توسعه سرطان و نتایج درمان است.
نتیجه گیری
تحقیقات رو به رشد بر اهمیت میکروبیوتای روده در بیولوژی سرطان تأکید میکند. استفاده از این دانش نویدبخش راهبردهای نوآورانه در پیشگیری، درمان سرطان و پزشکی شخصی است. با ادامه تلاشهای تحقیقاتی برای کشف پیچیدگیهای میکروبیوتای روده و پیامدهای آن برای سرطان، به طور فزایندهای آشکار میشود که این جامعه میکروبی پیچیده این پتانسیل را دارد که رویکرد ما در مدیریت سرطان را متحول کند و راه را برای عصر جدیدی در پزشکی دقیق هموار کند.
مترجم: مهشاد حیدریان
ویراستار: مرضیه رحیم خراسانی